단백질(protein)은 다양한 기관, 효소, 호르몬 등 신체를 이루는 주성분으로, 몸에서 물 다음으로 많은 양을 차지한다. 단백질의 구성단위 물질은 아미노산이며, 주로 인체 구성에 사용되고 에너지원으로도 드물게 사용된다.
펩타이드 결합
아미노산 사이의 펩타이드 결합에 의해 중합체가 형성된다. 펩타이드는 아미노산 단위의 수에 따라 다이펩타이드(2개), 올리고펩타이드, 폴리펩타이드라는 용어를 쓰지만 이들의 구별은 그렇게 분명하지 않다. 이 중 폴리펩타이드는 1차 구조, 2차 구조, 3차 구조 및 4차 구조로 나뉘어진다.
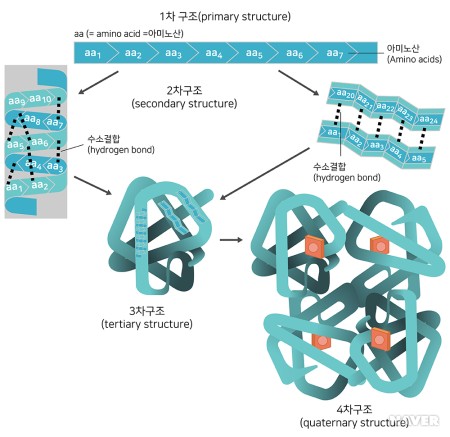
단백질의 구조
1차 구조
1차 구조는 아미노산이 펩타이드 결합으로 일렬로 배열된 상태를 말하며, 아미노-말단에서 카복실-말단 방향으로 합성된다. 아미노산들의 곁사슬인 R기가 다양하게 노출되고 이들의 상호 작용으로 더 복잡한 구조로 접히게 된다. 일반적으로 1차 구조 속에는 스스로 3차 구조로 접힐 수 있는 정보가 들어있다.
2차 구조
1차 구조에서 펩타이드 결합을 이룬 원자들 사이에서 수소결합을 형성해 생긴 단순한 입체 구조를 2차 구조라고 부른다. 크게 α-나선(α-helix) 구조와 β-병풍판(β-pleated sheet) 구조로 나뉠 수 있고, 각각 대표 단백질은 α-케라틴(keratin)과 명주 파이브로인(fibroin)이다.
3차 구조
3차 구조는 R기들 사이에 다양한 결합으로 폴리펩타이드 사슬이 접힌 복잡한 구조를 이루고 있다. 3차 구조를 이루는 결합에는 이온결합, 수소결합, 소수성결합, 반데르발스결합, 이황화결합 등이 관여한다. 3차 구조의 대표 단백질에는 미오글로빈이 있다.
4차 구조
4차 구조는 3차 구조의 폴리펩타이드 여러 개가 모인 구조이고, 폴리펩타이드 간에 이온결합, 수소결합, 소수성결합, 반데르발스결합, 이황화결합 및 R기들 사이에 다른 공유결합 등이 관여하기도 한다. 4차 구조의 대표 단백질에는 헤모글로빈이 있다.
이렇듯 단백질이 어떻게 접히느냐에 따라 단백질이 제 기능을 할 수 있을지 없을지가 결정된다. 단백질 접힘(folding)은 1차 구조 속에 스스로 접힐 정보가 있어 리보솜(ribosome)에서 번역되면서 동시에 열역학적으로 안정한 방향으로 자발적으로 접힐 수 있다. 또 스스로는 잘 접히지 못해서 샤페론(chaperone)의 도움을 통해 정상적인 구조로 접히는 경우가 있다. 샤페론의 경우 직접 ATP 에너지를 소모하면서 다른 단백질들의 접힘을 조절하게 된다.
단백질 역할
단백질은 우리 체내에서 여러 가지 역할을 수행한다. 미세섬유, 중간섬유, 미세소관을 통해서 세포 안을 지지하거나 콜라겐, 엘라스틴을 이용하여 세포 밖을 지지한다. 또 액틴과 미오신을 통해 신체의 운동을 조절하거나, 호르몬 등의 각종 리간드 물질이나 수용체와 같은 신호 전달자 역할도 한다. 그리고 세포막의 물질 수송 통로도 단백질이 관여하고, 효소와 항체도 단백질로 이루어져있다. 이 밖에도 생체 내 고분자 물질들의 수선과 유지를 담당하는 등 여러 기능을 한다.
단백질 정제
원하는 단백질을 순수하게 정제하기 위해서는 여러 단계의 과정을 거쳐야 한다. 일반적인 방법을 간단히 소개하면 다음과 같다.
- 균질화, 음파 파쇄 등을 통해 세포를 파쇄하고, 원심분리기를 이용해 불용성 세포찌꺼기와 단백질 수용액을 분리한 후, 침전물은 버리고 수용성 상층액을 수집한다.
- 황산암모니움 염석(ammonium sulfate fractionation)을 통해 표적 단백질이 존재하는 분획을 수집한다.
- 투석을 통해 염을 제거한다.
- 크로마토그래피를 통해 단백질들을 분리시킨다. 이때 사용되는 크로마토그래피는 충진제에 따라 여러 가지로 나눌 수 있는데, 크기에 따라 분리하는 젤 여과(gel filtration) 크로마토그래피, 전하에 따라 분리하는 이온교환(ion exchange) 크로마토그래피, 친화력에 따라 분리하는 친화(affinity) 크로마토그래피, 소수성 정도에 따라 단백질을 분리하는 소수성(hydrophobic) 크로마토그래피가 대표적이다.
- 등전점(pI) 전기영동을 시행하여 샘플 속에 섞여 있는 단백질을 pI 값에 따라 각각 분리시켜 준다. 보통 각종 크로마토그래피 결과 최종 2~3종류의 단백질들이 섞여 있을 경우에 흔히 사용한다.
- SDS-PAGE를 진행해 마지막 정제 단계의 샘플 내에 단백질 밴드가 하나임을 확인한다. SDS-PAGE는 각 단백질들을 분자량에 따라 밴드 형태로 분리하는 실험법이며, 샘플 속 단백질들의 수, 종류, 각 단백질의 양 그리고 각 단백질의 크기 등을 알 수 있다.
단백질 동정
단백질을 실험실에서 동정하기 위해서는 단백질 내에 있는 아미노산 서열을 분석해야 한다.
- 단백질의 3차 구조를 변성시킨다.
- 분석하려는 폴리펩타이드에 단백질 분해효소들(예를 들면 트립신, 펩신 등)을 처리해 서로 다른 절편들을 얻는다.
- 크로마토그래피나 등전점 전기영동 등으로 각 절편들을 따로 분리한다.
- 생어법과 에드만 분해법을 연속적으로 수행해 절편 내 아미노산 순서의 정보를 획득한다. 이 두 가지 방법에 대하여 간단히 설명하면, 생어법은 폴리펩타이드의 아미노-말단에 공유결합하는 FDNB(1-fluoro-2,4-dinitrobenzene)를 처리하고 폴리펩타이드를 아미노산 단위로 모두 절단한다. 그리고 2D-크로마토그래피를 수행해 각 아미노산들을 분리한 후, FDNB-아미노산에 해당하는 물질이 무엇인지 검출한다. 에드만 분해법은 폴리펩타이드 아미노-말단에 공유결합하는 PITC(phenylisothiocyanate, Edman reagent)를 처리하고, 공유결합한 PITC가 아미노-말단 아미노산 한 개를 절단해 낸다. 그리고 아미노-말단 아미노산 한 개가 절단되고 남은 폴리펩타이드 절편을 분리하여 아미노산 서열을 알아내는 방법이다.
- 얻어진 각 절편들의 서열을 순서대로 맞춘다.
- 단백질 서열 내 이황화결합 위치를 찾아낸다. 여기까지가 단백질을 동정하는 일반적인 방법이고, 이후 동정된 단백질을 클로닝해서 연구를 더 진행하기 위해서는 다음과 같은 방법을 시도해야 한다.
- 트리플렛 코드 표를 이용해서 단백질 서열로부터 DNA 서열을 역으로 유추한다.
- 모델 생명체의 유전자 서열을 찾아낸 후, 데이터베이스에서 비슷한 서열을 지닌 인간의 유전자를 검색한다.
- 환자의 유전자를 클로닝하고 분석해서 정상의 인간 유전자 서열과 비교한다.
출처
본 컨텐츠의 저작권은 저자 또는 제공처에 있으며, 이를 무단 이용하는 경우 저작권법 등에 따라 법적책임을 질 수 있습니다.
외부 저작권자가 제공한 콘텐츠는 네이버의 입장과 다를 수 있습니다.
-
제공처
생화학분자생물학회(Korean Society for Biochemistry and Molecular Biology, KSBMB)는 대한민국 생화학 분야에서 가장 오래된 역사를 가진 학술단체이다. 2010년 1월에 생화학 및 분자생물학 분야의 양대 학회였던 대한생화학회(1948년 설립)와 한국생화학분자생물학회(1967년 설립)가 통합하여 생화학분자생물학회로 재출범하였다.
현재 1만 4천여 명의 회원을 보유, 국제학술대회 및 연 4회 이상의 국내학술대회를 개최하고 있으며, 의약학 및 의생명과학 분야에서 국내 최고의 Impact Factor를 기록한 국제학술지인 <Experimental and Molecular Medicine(EMM)>과 아시아 최초 Reports형식으로 구성된 SCIE 등재 국제학술지인 <Biochemistry and Molecular Biology Reports(BMB Reports)>를 발행하고 있다. - 일러스트 제작
- 교정∙교열