열역학의 표준온도로 켈빈온도라고도 한다. 단위는 K이다. 절대영도를 온도의 기준점인 0 K로 하고, 섭씨온도와 같은 온도눈금으로 잰 온도가 절대온도이다. 즉, 두 온도의 차이가 절대온도로 1 K라면, 섭씨온도로도 1 °C이다. 절대영도는 자연에서 존재할 수 있는 가장 낮은 온도이다. 절대온도 @@NAMATH_INLINE@@T@@NAMATH_INLINE@@와 섭씨온도 @@NAMATH_INLINE@@c@@NAMATH_INLINE@@의 관계는 @@NAMATH_INLINE@@T = c + 273.15@@NAMATH_INLINE@@로 주어진다. 즉, 절대영도는 -273.15 °C이다.
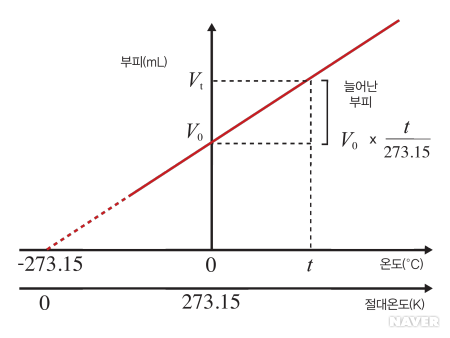
샤를의 법칙과 절대온도
여러 종류의 기체를 이용한 실험에서, 일정한 압력에서 온도를 점점 낮추면 기체의 부피가 점점 줄어드는 것을 볼 수 있다. 이를 샤를의 법칙이라고 한다. 실제의 기체는 온도를 낮춰가면 액화가 일어나서 기체상태에서 액체상태로의 상전이가 일어나지만, 분자 사이의 상호작용을 무시하는 이상기체를 상정하면, 이상기체의 부피가 결국 0으로 수렴하는 특정한 온도가 이론적으로 존재할 것으로 추측할 수 있다. 바로 이 온도가 절대영도이다. 절대영도를 최저 온도의 기준점으로 하고, 섭씨온도와 같은 온도눈금으로 정의한 온도가 바로 절대온도다.
기체분자운동론과 절대온도
계를 구성하는 분자의 운동에너지의 평균값은 온도가 올라가면 증가한다. 거꾸로 온도를 점점 내리면, 고전역학적인 분자들의 운동에너지는 결국 0이 될 것을 예상할 수 있다. 이 온도가 바로 절대영도이다. 운동에너지는 속도의 제곱에 비례하므로, 항상 0보다 크거나 같은 값만을 가질 수 있으므로, 절대영도에 해당하는 온도에서 출발해서 온도를 더 낮추는 것은 불가능하다.
양자역학적인 계와 절대온도
양자역학을 따르는 계는 온도가 점점 내려가면 더 낮은 에너지 상태에 도달하게 된다. 만약 계가 가질 수 있는 에너지의 바닥상태가 오로지 하나로 유일하다면, 온도가 내려갈 때 결국 계는 이 에너지 바닥상태에 놓이게 되는데, 이 온도가 바로 절대영도이다. 양자역학을 통해서 잘 이해할 수 있는 흑체복사 현상에서는 흑체가 발산하는 에너지의 총량이 흑체의 온도의 네제곱에 비례한다는 스테판-볼츠만 법칙이 잘 알려져 있다. 이 법칙의 온도 단위도 절대온도이다.
열역학제일법칙과 절대온도
열역학제일법칙은 계의 내부에너지 @@NAMATH_INLINE@@U@@NAMATH_INLINE@@의 변화량 @@NAMATH_INLINE@@dU@@NAMATH_INLINE@@가 계에 유입된 열에너지와 일의 양과 같아야 한다는 에너지보존법칙이다. 가역적인 준정적과정을 상정하면 내부에너지의 변화량(@@NAMATH_INLINE@@dU@@NAMATH_INLINE@@)을 엔트로피의 변화량(@@NAMATH_INLINE@@dS@@NAMATH_INLINE@@)과 부피의 변화량(@@NAMATH_INLINE@@dV@@NAMATH_INLINE@@)을 이용해 아래와 같이 쓸 수 있다.
@@NAMATH_DISPLAY@@dU = TdS - pdV @@NAMATH_DISPLAY@@
여기서 @@NAMATH_INLINE@@T@@NAMATH_INLINE@@는 절대온도, @@NAMATH_INLINE@@p@@NAMATH_INLINE@@는 압력이다. 위의 식을 이용해 절대온도를 아래와 같이 정의할 수 있다.
@@NAMATH_DISPLAY@@\frac{1}{T} = \left( \frac{\partial S}{\partial U}\right)_V . @@NAMATH_DISPLAY@@
따라서, 절대온도 @@NAMATH_INLINE@@T@@NAMATH_INLINE@@가 0보다 낮을 수 없다는 것은, 부피 @@NAMATH_INLINE@@V@@NAMATH_INLINE@@가 일정할 때 엔트로피 @@NAMATH_INLINE@@S@@NAMATH_INLINE@@가 계의 에너지의 증가함수라는 것과 관계가 있다는 것을 알 수 있다. 또, 볼츠만의 엔트로피 공식 @@NAMATH_INLINE@@S(E) = k_B \log W(E)@@NAMATH_INLINE@@로 부터, 계의 에너지가 @@NAMATH_INLINE@@E@@NAMATH_INLINE@@일 때, 계가 가질 수 있는 미시적인 상태의 수 @@NAMATH_INLINE@@W@@NAMATH_INLINE@@는 @@NAMATH_INLINE@@E@@NAMATH_INLINE@@의 증가함수라는 것도 알 수 있다. 만약, 높은 에너지에서 더 많은 미시적인 상태가 존재한다면, 절대온도 @@NAMATH_INLINE@@T@@NAMATH_INLINE@@는 0보다 크거나 같아야 한다.
음의 절대온도
위의 논의로부터, 만약 특정한 조건에서 엔트로피가 에너지의 감소함수가 될 수 있다면, 음의 절대온도가 가능하다는 것을 생각할 수 있다. 엔트로피가 에너지의 함수로 감소하다가 극소점을 지나 다시 증가하는 경우, 계의 에너지가 엔트로피의 극소점에 미치지 못할 때는 음의 절대온도를, 극소점을 지나서는 양의 절대온도를 갖게 된다. 즉, 음의 절대온도에 도달하기 위해서는 양의 값을 갖는 절대온도가 양의 무한대에 먼저 도달(@@NAMATH_INLINE@@1/T \rightarrow 0+@@NAMATH_INLINE@@)해야 하고 이를 넘어 @@NAMATH_INLINE@@1/T \rightarrow 0-@@NAMATH_INLINE@@가 가능해지면 음의 절대온도가 구현된다. 이로부터, '음의 절대온도는 양의 절대온도보다도 더 뜨겁다'는 설명을 이해할 수 있다. 즉, 현실에서 양의 절대온도를 가지는 계에서 출발해서 온도를 낮추어 음의 절대온도에 도달하는 것은 불가능하지만, 적절히 구현한 실험상황에서 계를 음의 절대온도의 상태에 놓게 되면, 계는 계속 음의 절대온도를 가지게 된다. 에너지의 함수로서의 엔트로피의 극대값이 어떤 에너지값에서 존재해서, 그보다 더 높은 에너지에서는 엔트로피가 줄어드는 다양한 이론적인 모형계가 있다. 상호작용하지 않는 이준위계 (non-interacting two-level system)가 대표적인 예이다.
출처
본 컨텐츠의 저작권은 저자 또는 제공처에 있으며, 이를 무단 이용하는 경우 저작권법 등에 따라 법적책임을 질 수 있습니다.
외부 저작권자가 제공한 콘텐츠는 네이버의 입장과 다를 수 있습니다.
-
제공처
물리학 및 과학의 발전에 이바지하고, 그 응용 지식을 널리 보급하는데 기여하기 위하여 설립된 학회. 1952년에 창립되었으며, 12개의 분과와 7개의 지부, 20,000 여명의 회원을 가진 국내 물리학 분야의 대표적인 학회이다. SCI 등재 학술지 <JKPS>, <CAP>, SCOPUS 등재 학술지 <새물리>, 홍보지 <물리학과 첨단기술>을 발행하고 있다.